ラムナン硫酸の抗SARS-CoV-2活性 (2)
要約
COVID-19のパンデミックは、人間の健康に関する主要な懸念事項です。COVID-19の原因となる病原体である重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は、スパイク(S)タンパク質と宿主細胞受容体であるアンジオテンシン変換酵素2(ACE2)との相互作用を通じて宿主に侵入します。ACE2に加えて、宿主細胞の表面にあるヘパラン硫酸(HS)も補助受容体として重要な役割を果たします。私たちのこれまでの研究では、ヘパリンやフコイダンなどの硫酸化グリカンが抗COVID-19活性を示すことを示しました。今回の研究では、緑藻類ヒトエグサ由来のラムノース骨格を持つ多糖類であるラムナン硫酸(RS)とSARS-CoV-2由来Sタンパク質との結合およびin vitroでのウイルス感染性の阻害について評価しました。 RSの構造特性は、その単糖組成を決定し、二次元核磁気共鳴を用いることにより調べました。高度に硫酸化されたHSであるヘパリンとSARS-CoV-2スパイクタンパク質(野生型および異なる多様な変異体由来)との相互作用におけるRSの阻害作用を、表面プラズモン共鳴(SPR)を使用して研究しました。競合的結合研究では、 固定化ヘパリンに結合するSタンパク質受容体結合ドメイン(RBD)に対するRSのIC50は1.6ng / mLであり、ヘパリンのIC50(〜750 ng / mL)よりもはるかに低い値でした。RSは、固定化されたヘパリンに結合するSタンパク質RBDまたは偽ウイルス粒子に対してヘパリンよりも強い阻害作用を示しました。最後に、in vitroの細胞ベースのアッセイで、RSは野生型SARS-CoV-2およびデルタ変異体に対して強力な抗ウイルス活性を示しました。
2.3. SARS-CoV-2 S-プロテインRBDとヘパリンの相互作用
SARS-CoV-2 S-プロテインRBD(野生型(wt)および変異体)とヘパリンの相互作用における結合速度および親和性を、SPRを用いて固定化ヘパリンを備えたセンサーチップにより測定しました( 図4および 図5)。T200 Evaluationソフトウェアを使用して1:1 Langmuirモデルにグローバルフィッティングしたセンサーグラムから、結合動力学的パラメータ(kaとkd)および親和性(KD)を算出した(表1)。S-プロテインRBDのさまざまな変異体の結合速度と親和性のほとんどは、ヘパリンへのより高い親和性を示すN501Yと、より低い親和性を示すL452Rを除いて、野生型バージョンと同等です。
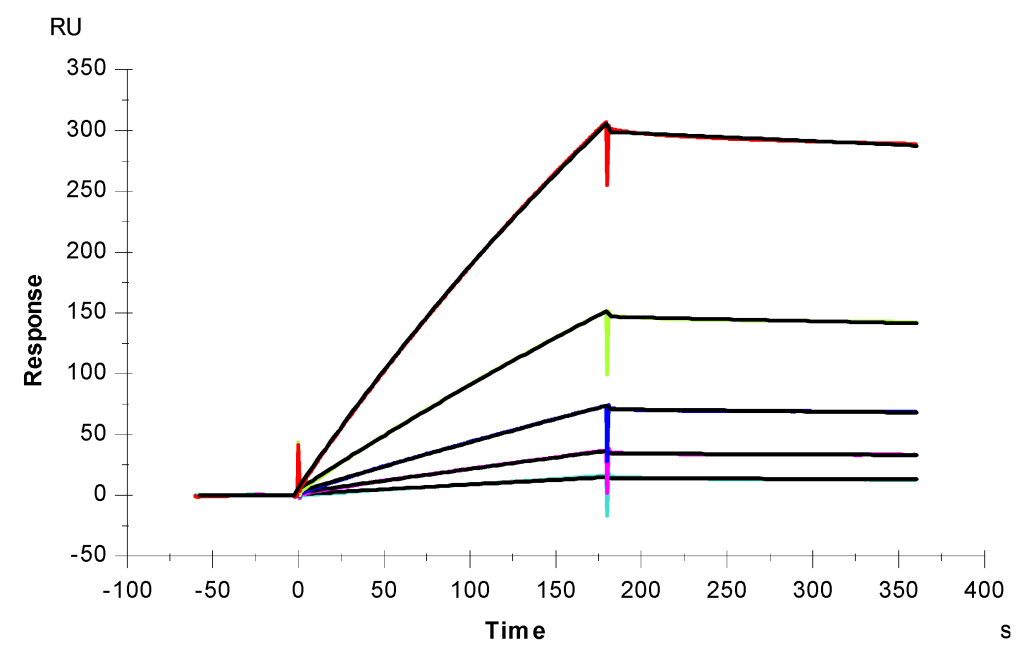
図4. S-プロテインRBD(wt)とヘパリン間相互作用のSPRセンサーグラム。 S-プロテインRBDの濃度(上から下へ):それぞれ1000、500、250、125、および63nM。 黒い曲線は、T200 Evaluationソフトウェアのモデルを使用したフィッティングカーブです。
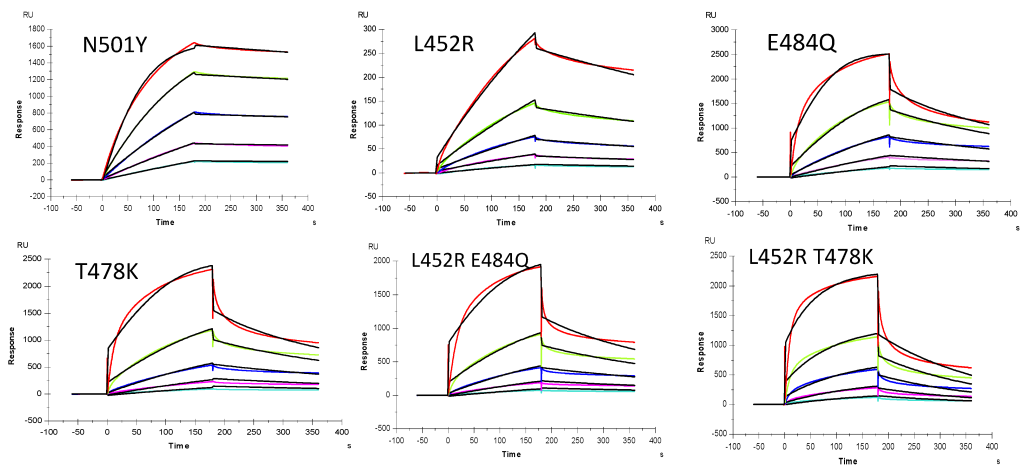
図5. S-プロテインRBD変異体とヘパリン間相互作用のSPRセンサーグラム。 S-タンパク質変異体の濃度(上から下へ):それぞれ1000、500、250、125、および63nM。 黒い曲線は、T200 Evaluateソフトウェアのモデルを使用したフィッティングカーブです。
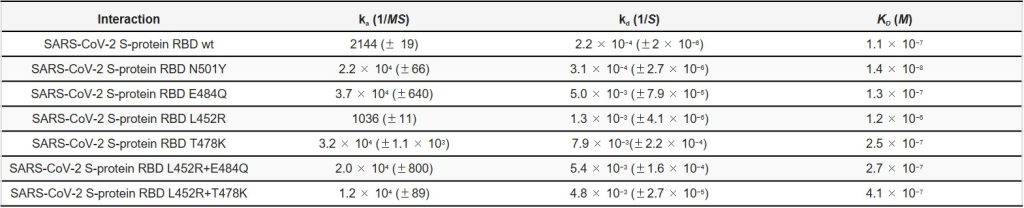
表1. ヘパリンとSARS-CoV-2Sタンパク質RBD(wtおよび変異体)の相互作用の速度論データの要約*。
2.4. S-タンパク質とヘパリンの結合におけるRSの阻害作用について溶液競合SPRを用いたIC50の測定
ヘパリン(表面上)とwt Sタンパク質の相互作用を阻害するRSの能力を調べるために、表面固定化ヘパリンと可溶性RSの間で溶液競合用量反応分析を行い、IC50値を計算しました(図6)。 Sタンパク質は、ヘパリンチップに注入する前に、各濃度のRSまたはヘパリンと混合しました。 Sタンパク質の活性結合部位が溶液中の糖鎖によって占められると、表面に固定化されたヘパリンへの結合が減少し、濃度依存的にシグナルが減少しました。 IC50値は、Sタンパク質結合シグナル(正規化)と溶液中の糖鎖濃度のプロットから計算されました。 RSのIC50値は1.6ng / mLであり、これはポジティブコントロールのヘパリン(IC50約750 ng / mL)よりも大幅に低い値です。
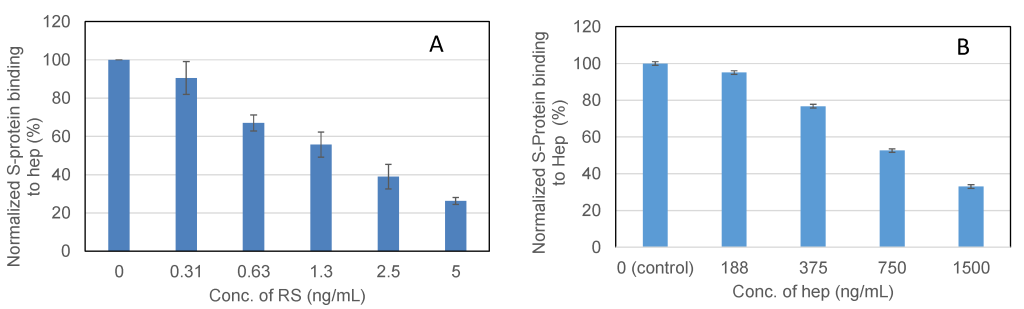
図6. S-タンパク質とヘパリンの結合におけるRSの阻害作用について溶液競合SPRを用いたIC50の測定
測定したRSのIC50 = 1.6 ng / mL(A); ヘパリンのIC50 =約750 ng / mL(B)。 エラーバーは、3回のテストからの標準偏差を表します。
2.5. 溶液競合SPRを用いたS-タンパク質RBD変異体とヘパリンの結合におけるRSの阻害作用
SPRを用いた溶液/表面競合実験を実施し、RSがS-タンパク質RBD変異体とヘパリン間の相互作用を阻害する能力を調べました(図7)。 同じ濃度のRSとヘパリン(5ng / mL)を使用すると、RSはSタンパク質変異体E484QおよびL452R + E484Qでより強い阻害作用を示し、T478Kではヘパリンと同等の阻害作用を示しました。
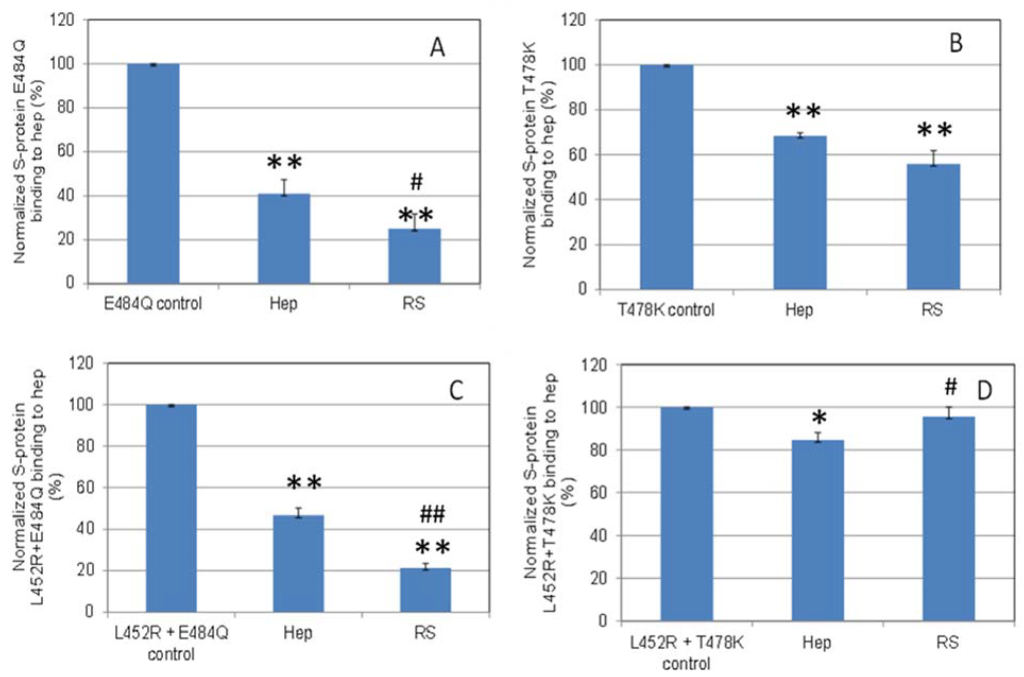
図7. 正規化されたSタンパク質変異体の棒グラフ(標準偏差を使用した3回の実験に基づく):
(A)E484Q; (B)T478K; (C)L452R + E484Q; (D)L452R + T478Kそれぞれと表面ヘパリンの結合に対する溶液中の5 ng / mLのRSまたはヘパリンの阻害作用。 統計分析は、両側スチューデントのt検定を使用して行われ、2つの異なる独立したグループを比較しました。*コントロールと比較してp <0.05、**コントロールと比較してp <0.01。 ヘパリンと比較して#p <0.05、ヘパリンと比較して## p <0.01。
2.6. ヘパリンと偽ウイルス粒子の相互作用におけるRSの阻害作用に関するSPR溶液競合研究
様々な疑似ウイルス粒子(野生型およびデルタ変異体)-ヘパリン間相互作用のRSによる阻害能を定量化するために、溶液/表面競合実験を実施しました(図8)。RSは、表面ヘパリンへの結合阻害において、野生型でより強い阻害作用を示し、デルタ変異型シュードウイルス粒子では溶液中のヘパリンと同等の阻害作用を示しました。
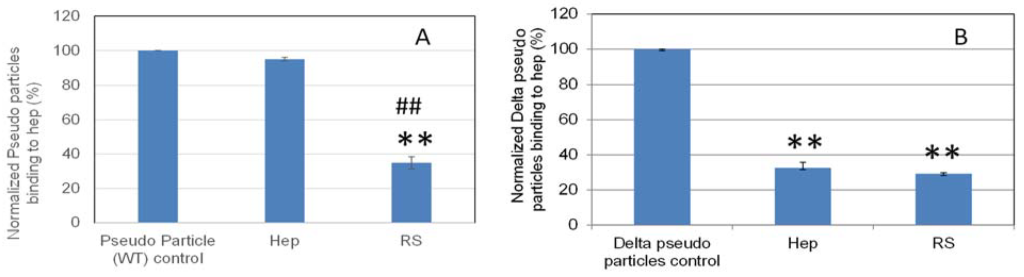
図8. RSまたはヘパリンの阻害作用によって表面ヘパリンに結合する正規化された疑似ウイルス粒子の棒グラフ(標準偏差を使用した3回の実験に基づく)
(A)溶液中の5 ng / mLの濃度でRSまたはヘパリンによって阻害された野生型偽ウイルス粒子。 (B)溶液中の5 µg / mLの濃度でRSまたはヘパリンによって阻害されたデルタ変異型シュードウイルス粒子。 統計分析は、両側スチューデントのt検定を使用して行われ、2つの異なる独立したグループを比較しました。**コントロールと比較してp <0.01。 ##ヘパリンと比較してp <0.01。
2.7. インビトロにおけるSARS-CoV-2疑似型ウイルスの中和
ヘパリンなどの糖鎖は、SARS-CoV-2スパイクタンパク質と相互作用することによってウイルス感染を阻害することが示されています[26]。そのため、SARS-CoV-2偽ウイルス粒子の細胞ベースの中和アッセイにより、ウイルス侵入を阻害するRSの能力を調べました。 ACE-2受容体を安定して発現するHEK293T細胞(HEK293T-ACE2)を使用しました。 6つの異なる濃度を1/10ウイルス希釈液でテストし、機能的なウイルス侵入のマーカーとしてのEGFPの発現に基づいて、ウイルス阻害のIC50値を決定できます。簡潔に説明すると、RSをシュードウイルス粒子とともに37℃で1時間インキュベートした後、混合物をHEK293T-ACE2細胞に添加し、4時間インキュベートしました。血清には多糖類と相互作用する成長因子が含まれていることが多く、スパイクタンパク質との相互作用を妨げるため、これらのインキュベーションステップはゼノフリーの条件下で行いました。 4時間のインキュベーション後、血清との培地交換を行い、細胞増殖を48時間維持し、その後、プレートをEGFPの発現についてアッセイしました。中和実験の結果を図9に示します。y軸は、実験で得られた最大感染力のパーセンテージを表します。各濃度について、感染細胞の割合を、コントロール(RSなしおよび1:10ウイルス希釈)と比較した感染細胞の割合に正規化しました。図9に示すように、RS濃度1μg/ mLでの最低希釈により、野生型とデルタ変異体の両方で80%を超えるウイルス侵入阻害がもたらされ、IC50値はそれぞれ2.39および1.66μg/ mLになりました。
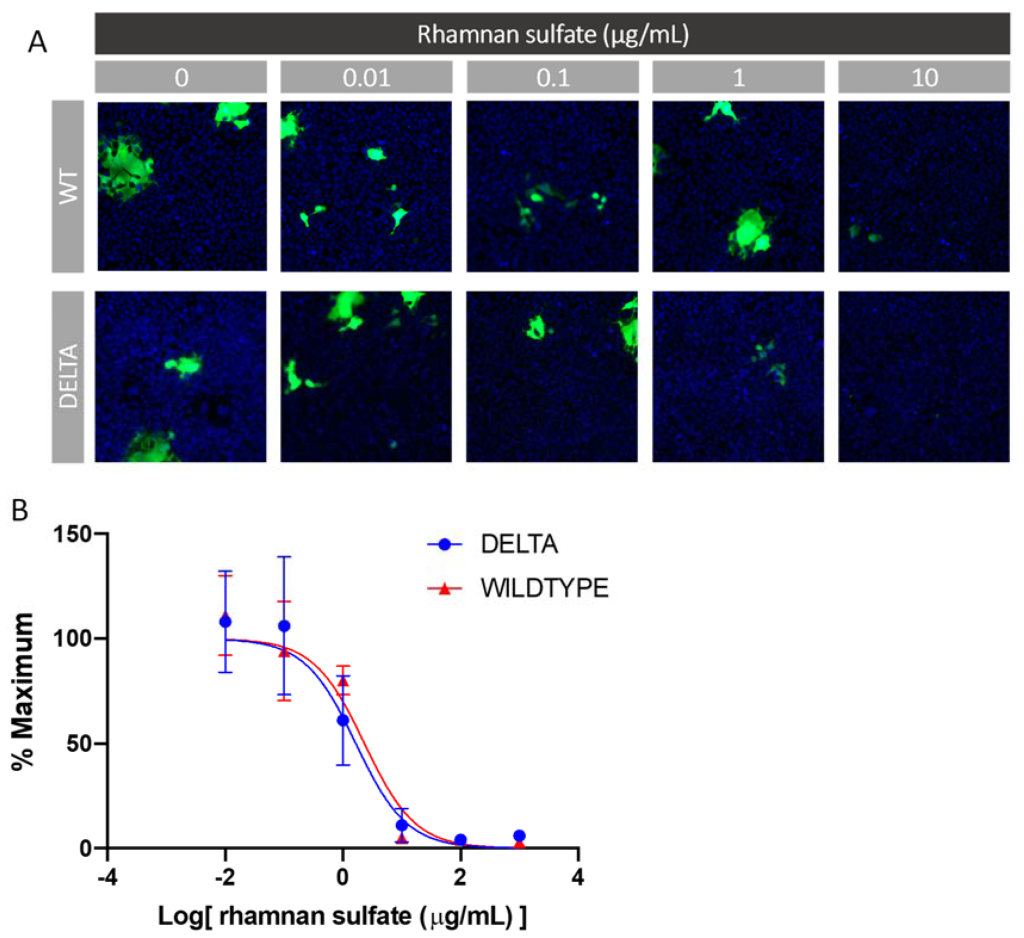
図9. in vitro SARS-CoV-2疑似型ウイルス(wtおよびdelta変異体)中和アッセイ
(A)各濃度のRSにおける阻害剤アッセイの代表的な蛍光顕微鏡観察の結果。 (B)SARS-CoV-2疑似型ウイルス(wtおよびdeltaバリアント)を阻害するRSのIC50曲線。
(データ:Marine Drugs, 2021, 19(12), 685, DOI: 10.3390/md19120685)

